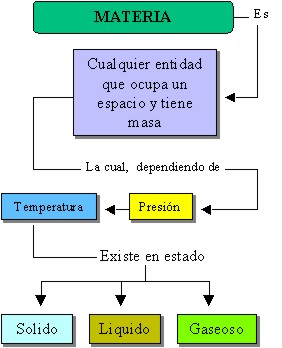
¿QUÉ ES LA MATERIA?
Sus propiedades fundamentales son Masa , Volumen, Tiempo, Densidad.
Podemos decir que es materia todo lo que tiene masa y ocupa volumen.
Masa.- es la cantidad de materia que contiene un cuerpo.Se mide en gramos.
Volumen.-es lo que ocupa un lugar en el espacio, tiene tres dimensiones: ancho, largo y alto. Se mide en centímetros cúbicos.

Densidad.-propiedad que depende de la masa y el volumen correspondiente a una determinada cantidad de materia, mientras mayor sea la cantidad de materia contenida en una unidad de volumen mayor será la densidad y viceversa.

Tiempo.- es una magnitud física que mide la duración o separación de acontecimientos que sirve para medir la materia como los objetos tienen una duración limitada para luego convertirse en otra cosa.
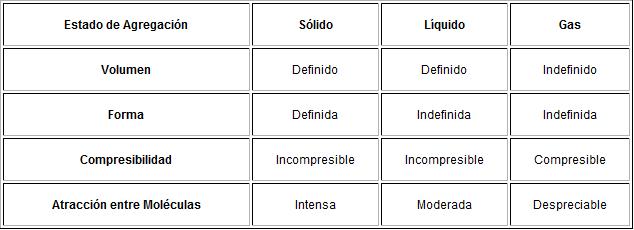
ESTADOS DE LA MATERIA
En la materia si se modifican sus condiciones de temperatura o presión se obtiene distintos estados:
Sólido.- los objetos se muestran como cuerpos definidos,sus moléculas están unidas,tienen la capacidad de soportar fuerzas sin sufrir deformaciones aunque también pueden ser frágiles.
Tienen una ligera vibración.
Líquido.- no poseen forma definida ya que sus moléculas no pueden mantener una posición fija, estas están menos separadas,pueden adoptar la forma del recipiente que lo contiene.
Gaseoso.- no tienen forma definida, sus moléculas están muy separadas y pueden distribuirse por toda dirección. Pueden ocupar cualquier recipiente.
Plasmático.- es un estado parecido al gaseoso con gas ionizado conformado por átomos que se han roto perdiendo electrones y quedándose con una carga eléctrica positiva y pueden estar en completo movimiento. Como ejemplo tenemos al Sol, las estrellas.

CAMBIOS DE ESTADO
- Fusión: paso de un sólido a un líquido.Ejemplo: el hielo a agua líquida se funde.
- Vaporización: paso de un líquido a un gaseoso.Ejemplo: el agua líquida pasa a vapor de agua .
- Sublimación: paso de un sólido a gas sin pasar por el estado líquido.Ejemplo: el azufre es sólido al calentarlo pasa directamente a gas.
- Sublimación inversa: paso directo del estado gaseoso al estado sólido.
- Licuación: paso de un estado gaseoso a líquido por acción de la temperatura y el aumento de presión.
- Solidificación: paso de líquido a sólido.Ejemplo: el agua de una cubitera dentro del congelador se solidifica formando cubitos de hielo.
CLASIFICACIÓN DE LA MATERIA

Sustancias puras: material homogéneo cuya composición química es invariable.
-Elementos Químicos: sustancia conformada por una sola
clases de átomos.
-Compuestos: sustancias conformada por varias clases de átomos.


Mezclas: compuestas de dos o más sustancias puras.
-Mezcla homogénea: constituido por una sola sustancia o por varias que se encuentran en una sola fase. No se pueden distinguir.
-Mezcla heterogénea: mezcla de sustancias en más de una fase , son distinguibles.
CAMBIOS EN LA MATERIA
Cambio Físico: cambio que sufre la materia en su forma, volumen, estado sin alterar su composición. Ejemplo : una piedra que se rompe sufre un cambio físico pero sigue siendo una piedra.
Cambio Químico: variación en su composición, la materia se transforma en otra . Ejemplo: un papel que arde sufre un cambio químico.

PROPIEDADES DE LA MATERIA
La materia presenta diversas propiedades que la caracterizan, estas pueden ser propiedades generales que identifican a toda la materia, las propiedades particulares de la materia sólida y líquida, y las propiedades específicas que determinan las diferencias entre una sustancia y otra .
Propiedades generales
- Peso: acción que ejerce la fuerza de gravedad sobre los cuerpos.
- Divisibilidad: propiedad que tienen los cuerpos de poder dividirse en pedazos más pequeños hasta llegar a las moléculas y los átomos.
- Porosidad: como los cuerpos están formados por partículas diminutas, estas dejan espacios entre sí llamados poros.
- Inercia: todos los cuerpos tienden a mantenerse en su estado de reposo o movimiento, mientras no se aplique fuerza sobre ellos.
- Impenetrabilidad: hace que un cuerpo no pueda ocupar el espacio de otro, al mismo tiempo.
Propiedades Particulares
-Elasticidad: permite a la materia recuperar su forma y tamaño originales al dejar de aplicarle una fuerza.-Dureza: resistencia de los cuerpos a ser rayados , cortados o penetrados.
-Tenacidad: resistencia de los cuerpos a deformarse o romperse cuando se les aplica una fuerza.
-Fragilidad:hace que la materia se fragmente fácilmente.
-Maleabilidad:capacidad de los sólidos en convertirse en láminas delgadas
-Plasticidad: un cuerpo es deformado por acción de una fuerza, pero no retoma su forma original cuando dejamos de someterle dicha fuerza. Ejemplo: plastilina, arcilla .
-Ductilidad: capacidad de los sólidos para transformarse en hilos o alambres.
-Viscosidad: resistencia que manifiesta un líquido al fluir.
-Capilaridad: capacidad que tienen los líquidos para subir por tubos de diámetros pequeñísimos.
Propiedades Específicas
Entre estas propiedades tenemos: densidad , punto de ebullición,punto de fusión,solubilidad, reactividad, electronegavidad, alcalinidad,acidez,etc.
QUÍMICA
Se denomina química (del árabe kēme (kem, كيمياء), que significa tierra) a la ciencia que estudia tanto la composición, estructura y propiedades de la materia como los cambios que ésta experimenta durante las reacciones químicas y su relación con la energía.
QUÍMICA INORGÁNICA
Se encarga del estudio integrado de la formación,
composición, estructura y reacciones químicas de los elementos y compuestos
inorgánicos (por ejemplo, ácido sulfúrico o carbonato cálcico); es decir, los
que no poseen enlaces carbono-hidrógeno, porque éstos pertenecen al campo de la
química orgánica.
FORMULACIÓN:
1. VALENCIA
Capacidad que tiene un átomo de un elemento para combinarse con los átomos de otros elementos y formar compuestos.
La valencia es un número , positivo o negativo que nos indica el número de electrones que gana,pierde o comparte un átomo con otro átomo(s)
2 VALENCIAS DE LOS METALES MÁS IMPORTANTES DEL S. PERIÓDICO
METALES:


HIDRÓGENO:

3 NOMENCLATURAS
Para nombrar los compuestos químicos inorgánicos se siguen las normas de la IUPAC. Se aceptan 3 tipos de nomenclaturas para los inorgánicos la sistemática, la nomenclatura de stock y la tradicional.

4 ÓXIDOS
Compuestos binarios formados por la combinación de un elemento y oxígeno.
Tipos:
- Óxidos básicos: se forman con un metal + oxígeno, los óxidos de elementos menos electronegativos tienden a ser básicos. Se les llaman también anhídridos básicos; ya que al agregar agua, pueden formar hidróxidos ejemplo: Na2O, CaO, Li2O, MgO
- Óxidos ácidos: son los formados con un no metal + oxígeno, los óxidos de elementos más electronegativos tienden a ser ácidos. Se les llaman también anhídridos ácidos ya que al agregar agua, forman oxácidos ejemplos SO3, SO2, CO3.
- Óxidos anfotéricos: se forman cuando participa en el compuesto un elemento anfótero. Los anfóteros son óxidos que pueden actuar como ácido o base según con lo que se les haga reaccionar. Su electronegatividad tiende a ser neutra y estable, tiene punto de fusión bajo y tienen diversos usos.

5 HIDRUROS
Compuestos binarios formados por un metal e hidrógeno.

6 HIDRUROS DE NO METALES
Hay no metales como el nitrógeno , fósforo, arsénico, carbono, etc que forman compuestos con el hidrógeno y que reciben nombres especiales .

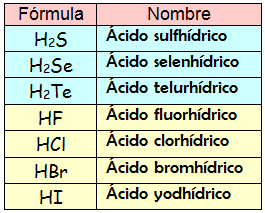
7 ÁCIDOS HIDRÁCIDOS
Compuestos binarios formados por un no metal e hidrógeno.
Los no metales que forman estos ácidos son:
Fluor, cloro, bromo, yodo( valencia 1)
Azufre , selenio, teluro ( valencia 2)

8 HIDRÓXIDOS
Compuestos formados por un metal y el grupo hidroxilo (OH)
El grupo OH siempre tiene valencia 1
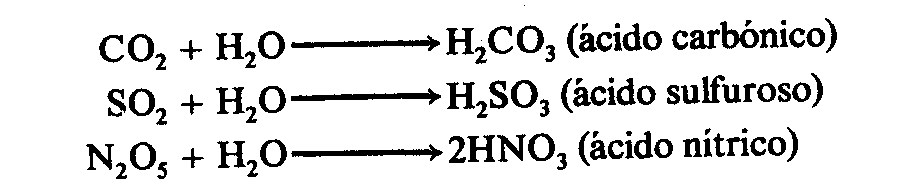
7 ÁCIDOS OXÁCIDOS
Compuestos ternarios formados por un anhídrido más agua.
QUÍMICA ORGÁNICA
La química orgánica o química del carbono estudia una clase numerosa de moléculas que contienen carbono
formando enlaces covalentescarbono-carbono o carbono-hidrógeno y otros
heteroátomos, también conocidos como compuestos orgánicos. Friedrich Wöhler y
Archibald Scott Couper son conocidos como los padres de la química orgánica

Friedrich Wöhler Archibald Scott Couper
HIDROCARBUROS
Los hidrocarburos son compuestos orgánicos formados
únicamente por átomos de carbono e hidrógeno. La estructura molecular consiste
en un armazón de átomos de carbono a los que se unen los átomos de hidrógeno.
Los hidrocarburos son los compuestos básicos de la Química Orgánica. Las
cadenas de átomos de carbono pueden ser lineales o ramificadas y abiertas o
cerradas.
Tipos:
Hidrocarburos Alifáticos:
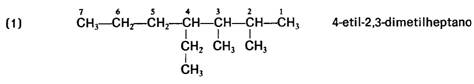
ALCANOS: Son compuestos de Carbono e Hidrógeno (de ahí el nombre de hidrocarburos)
de cadena abierta que están unidos entre sí por enlaces sencillos.
¿Cómo se nombran?
Los cuatro
primeros tienen un nombre sistemático que consiste en los prefijos met-, et-,
prop-, y but- seguidos del sufijo "-ano". Los demás se nombran mediante los prefijos
griegos que indican el número de átomos de carbono y la terminación
"-ano".
Normas para su correcta nomenclatura.
-Se numeran los átomos de carbono de la cadena principal
comenzando por el extremo que tenga más cerca alguna ramificación
-Las cadenas laterales se nombran antes y se ordenan por
orden alfabético.
ALQUENOS: Son hidrocarburos de cadena abierta que se caracterizan por tener uno o más dobles enlaces, C=C.
¿Cómo se nombran?
Se nombran igual
que los alcanos, pero con la terminación en "-eno". De todas formas,
hay que seguir las siguientes reglas:
-Se escoge como cadena principal la más larga que contenga el doble enlace
• La posición del doble enlace o instauración se indica
mediante el localizador correspondiente que se coloca delante del nombre.
Ejemplo:
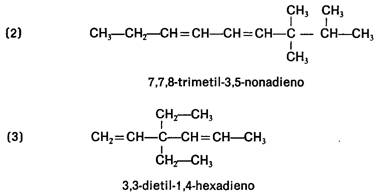
En el caso de que hubiera más de un doble enlace se emplean
las terminaciones, "-dieno", "-trieno", etc.
ALQUINOS: Son hidrocarburos de cadena abierta que se caracterizan por tener uno o más triples enlaces,
¿Cómo se nombran?
En general su nomenclatura sigue las pautas indicadas para los alquenos, pero terminando en "-ino".
Reglas:
En este caso, hay que indicar tanto los dobles enlaces como los triples, pero con preferencia por los dobles enlaces que serán los que dan nombre al hidrocarburo. Llamaremos a estos compuestos eninos, nombraremos antes los dobles enlaces y luego los triples.
Si en un compuesto existen dos o más triples enlaces, se utilizan para nombrarlo las terminaciones -adiino, -atriino, etc.,
COMPUESTOS OXIGENADOS
Son cadenas de carbono con uno o varios átomos de oxígeno
Estos pueden ser:

ALCOHOLES: Su estructura es similar a la de los hidrocarburos, en los que se sustituye uno o más átomos de hidrógeno por grupos "hidroxilo", -OH.
¿Cómo se nombran?
Se nombran como los hidrocarburos de los que proceden, pero con la terminación "-ol"
Según la posición del carbono que sustenta el grupo -OH, los alcoholes se denominan primarios, secundarios o terciarios.
Si en la molécula hay más de un grupo -OH se utiliza la terminación "-diol", "-triol", etc.,
ALDEHÍDOS: son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO. Se denominan como los alcoholes correspondientes, cambiando la terminación -ol por -al.
Reglas:
-Si hay dos grupos aldehídos se utiliza el término "-dial".
butanodial

CETONAS: es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo unido a dos átomos de carbono. -CO- .Se nombran con la terminación "-ona"
Reglas:
-Si hay dos grupos aldehídos se utiliza el término "-diona".

ÁCIDOS CARBOXÍLICOS: Se caracterizan por tener el grupo "carboxilo" -COOH en el extremo de la cadena.
¿Cómo se nombran?
-Se nombran anteponiendo la palabra "ácido" al nombre del hidrocarburo del que proceden y con la terminación "-oico".
-Son numerosos los ácidos dicarboxílicos, que se nombran con la terminación "-dioico"










.jpg)












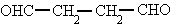


No hay comentarios:
Publicar un comentario